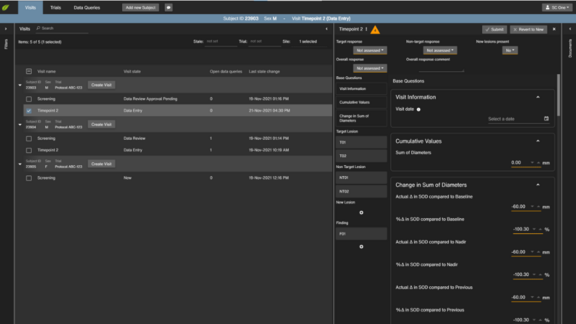
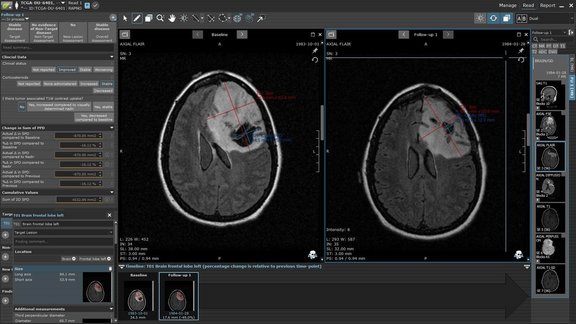
Wir alle kennen die Redewendung „ein Bild sagt mehr als tausend Worte“. In bestimmten Bereichen sind tausend Worte jedoch einfach zu viel und sogar potenziell problematisch. Radiolog:innen ziehen es in der Regel immer noch vor, ihre Berichte in Prosa zu verfassen, was für die Patientenversorgung oft ein Hindernis darstellt. Die unterschiedlichen Schreibstile der Radiolog:innen, gepaart mit unterschiedlichen Textlängen, Heckenausdrücken oder Tippfehlern, beeinträchtigen die Gesamtklarheit eines Berichts und erschweren es den überweisenden Ärzt:innen, die wesentlichen Informationen zu entnehmen [1]. Seit einiger Zeit wird versucht, radiologische Befundberichte effizienter und reproduzierbarer zu gestalten, indem die Wortzahl eines Berichts reduziert und gleichzeitig die Präzision und Homogenität durch die Verwendung strukturierter Berichte erhöht wird. Die Vorteile dieser Berichte sind vielfältig [1]. Für individuelle radiologische Arbeitsabläufe hat die strukturierte Befundung beispielsweise das Potenzial, zeitaufwändige Prozesse wie Rückfragen in Form von Anrufen und E-Mails von überweisenden Ärzt:innen oder Vorbereitungsarbeiten für Tumorboard-Präsentationen zu minimieren. Für das gesamte Gesundheitssystem könnte die strukturierte Befundung daher zu einer allgemeinen Verbesserung und Vereinheitlichung der Sprache führen, die die Interoperabilität klinischer Systeme [2] ermöglicht und potenzielle Vorteile für Big-Data-Analysen bietet [3].
Sicherlich hat die strukturierte Berichterstattung noch ihre Tücken. Sie kann zu höheren Klickraten, langen Klickwegen, ungewohnten Arbeitsabläufen oder Unsicherheiten bei der Programmnutzung führen. Verbesserungen sind auf jeden Fall erforderlich, um die Arbeitsabläufe der Radiolog:innen besser an die Anforderungen anzupassen [4]. Die Einbindung von künstlicher Intelligenz in strukturierte Befundungsworkflows kann einen solchen Wandel vorantreiben, bietet aber auch potenzielle Vorteile, die über die Steigerung der Effizienz der Radiolog:innen und die Verringerung von Fehlern oder Klickraten hinausgehen.
Die Integration von KI in die Vorgehensweise der radiologischen Berichterstellung ermöglicht eine andere Art der Interaktion. Dieser Vorgang akkumuliert gemeinsames Wissen über Patientendaten, die sowohl für den Computer als auch für den Benutzer verständlich und lesbar sind, und sorgt für eine Synchronisation zwischen den Informationen, die von Computern verarbeitet und verstanden werden, und den Informationen, die von Ärzt:innen verstanden und übermittelt werden. Dadurch wird auch die Zugänglichkeit der Daten für Radiolog:innen und andere medizinische Fachkräfte verbessert [5; 6]. Schlussendlich schafft es die Voraussetzungen für die Implementierung und das Training weiterer KI-Algorithmen, was zu einem kontinuierlichen Kreislauf der Wissensgenerierung führt. Eine langfristige Vision für diesen Prozess ist die automatisierte und KI-gesteuerte Erstellung eines Entwurfs des radiologischen Befundberichts, den die Radiolog:innen überprüfen und mit ihrem Fachwissen ergänzen können.
Aber wie können wir diese langfristige Vision verwirklichen? Und wie erleichtert eine strukturierte Berichterstattung die KI-Integration und damit die Big-Data-Analyse und die Verbesserung der Patientenversorgung? Die Verwirklichung dieser Vision ist ganz klar ein schrittweiser Prozess und erfordert die Bewältigung verschiedener Herausforderungen auf dem Weg dorthin.
Strukturierte Berichterstattung ist der Dreh- und Angelpunkt auf diesem Weg. Um anspruchsvolle KI-Algorithmen zu entwickeln, benötigen wir umfangreichere Trainingsdaten - Datensätze, die über annotierte Bilder hinausgehen und mehr Kontext bieten. „Ähnlich wie ein sich entwickelndes Gehirn benötigt die Entwicklung von KI-Algorithmen große Mengen an Trainingsdaten, idealerweise hochspezifische Daten, die korrekt referenziert und in möglichst strukturierter Form bereitgestellt werden.“ [7; siehe auch 8] Durch die konsistente Darstellung von Informationen ermöglichen strukturierte Berichte den KI-Modellen, Muster und Assoziationen zu erlernen, und dienen somit als wertvolle Trainingsdaten für KI-Algorithmen [9]. Die Quantität und Qualität der Daten haben einen erheblichen Einfluss auf das Lernen und die Leistung von KI-Algorithmen. Im Gesundheitswesen stammen die Daten oft aus unterschiedlichen Quellen, wie z. B. Krankenhäusern und Kliniken. Hier kommt das Konzept der Datenliquidität ins Spiel. Es ermöglicht die uneingeschränkte Nutzung zuvor gesammelter Daten nicht nur durch diejenigen, die sie gesammelt haben, sondern auch durch andere Beteiligte, in einem anderen Nutzungskontext und möglicherweise in anderen Systemen, während KI-Algorithmen auf eine Vielzahl von Patienteninformationen zugreifen können.
Strukturierte Berichte vereinfachen auch die Merkmalsextraktion. KI-Algorithmen können relevante Merkmale aus strukturierten Berichten effektiver extrahieren als aus unstrukturierten Prosaberichten [10], was den Arbeitsablauf der Radiolog:innen verbessert [11]. Dieser Fortschritt könnte beispielsweise zu patientenfreundlichen Multimedia-Berichten führen, die Links zu Erklärungen medizinischer Begriffe enthalten [1]. Darüber hinaus könnte die Kombination von „strukturierten radiologischen Berichten mit anderen Daten aus elektronischen Gesundheitsakten wie Umweltrisikofaktoren, Genomik und Histopathologie“ [1] zu Fortschritten in der personalisierten Medizin führen.
Auch hier besteht die Hauptanforderung darin, auf große Mengen von Datensätzen zugreifen zu können, die qualitativ hochwertige Annotationen enthalten [12], womit wir wieder beim KI-Training wären. Die Extraktion relevanter Informationen aus radiologischen Befundberichten mithilfe der Computerlinguistik (im Englischen auch natural language processing oder NLP) ist nicht fehlerfrei und kann möglicherweise falsche Beschriftungen zu einem Datensatz hinzufügen [12], was je nach Zweck des KI-Algorithmus aufgrund der damit verbundenen rechtlichen Anforderungen und Qualitätsanforderungen an die Trainingsdaten eine Herausforderung darstellen kann. Die Lösung liegt daher in der Erhebung bestmöglicher Daten direkt im Zuge der Befundung. Strukturierte Befundvorlagen wie iRECIST, RADS und das TNM-Klassifikationssystem sind für die genaue und umfassende Bewertung radiologischer Beobachtungen von entscheidender Bedeutung, um diese Befunde für das Training von KI-Algorithmen vorzubereiten [13]. Aktuelle Algorithmen wurden in der Regel nicht auf Daten aus der Primärversorgung trainiert, sondern erfordern, dass zertifizierte Radiolog:innen bestehende Fälle in einem zusätzlichen, sekundären Befundungsprozess annotieren. Aufgrund der tatsächlichen medizinischen Arbeitsabläufe ist die Schaffung dieser Grundlage derzeit eine mühsame Aufgabe, die erhebliche Anstrengungen, Zeit und finanzielle Ressourcen erfordert.
Strukturierte Befundung unterstützt die Radiologen dabei, KI Resultate direkt zu prüfen und dabei auch für das Reporting zu verwenden, daher müssen wir aber auch dafür sorgen, dass KI den Arbeitsablauf einer Radiologin unterstützen kann, um ihn von vornherein effizienter und strukturierter zu gestalten – zum Beispiel, indem die KI die Klickrate reduziert. Dies würde die strukturierte Befundung effizienter machen und ihren Mehrwert erhöhen. Alles in allem handelt es sich hier um einen gemeinsamen Anstrengungskreislauf, der den gesamten Prozess verbessern kann: zum einen, wie eine radiologische Auswertung durchgeführt wird und zum anderen, wie Radiolog:innen mit Computersystemen interagieren.
Als letzten Punkt erleichtert die standardisierte und homogenisierte Sprache in strukturierten Berichten auch die automatisierte Datenextraktion und Nachbearbeitung [14, 3], was den manuellen Aufwand und potenzielle Fehler erheblich reduziert. Derzeit werden KI-Tools oftmals als zusätzliches, externes Programm bereitgestellt. Bild- und klinische Daten werden in das KI-Tool eingespeist, das dann Ergebnisse in Form eines statischen Dokuments, z. B. einer PDF-Datei, erstellt. Radiolog:innen können diese Ergebnisse bei der Erstellung ihrer diktierten Berichte dann berücksichtigen. KI ist jedoch nicht perfekt: Die Ergebnisse können stellenweise fehlerhaft oder unvollständig sein und erfordern eine kritische Überprüfung und Ergänzung durch den Radiologen während des Diktiervorgangs. Die direkte Integration von KI in den strukturierten, bildbasierten Befundungsprozess verbessert die Verwendung von KI-Ergebnissen (wie z. B. bei Mint Medical und FUSE-AI in Prostatareports). Die KI-Ergebnisse werden in Mint so dargestellt, als ob sie von einem Assistenzarzt oder einer Assistenzärztin strukturiert erfasst worden wären, komplett mit Messungen und Klassifizierungen, so dass eine direkte Bestätigung, Korrektur und Ergänzung möglich ist. Durch diese Integration wird die derzeit noch bestehende Diskrepanz zwischen KI-Systemen und radiologischer Befundung verringert und es ist außerdem ein wichtiger Schritt in die Richtung, einen zuverlässigen, virtuellen Assistenten zu kreieren.
Es gibt zahlreiche faszinierende Ideen rund um das Thema künstliche Intelligenz in der Medizin, aber alles in allem ist künstliche Intelligenz in der Radiologie nicht mehr wegzudenken: Sie „hat das Potenzial, einen erheblichen Mehrwert für unsere Patientenversorgung zu schaffen und die Möglichkeiten der Bildgebung zu erweitern“ [15].
Um dieses Potenzial zu nutzen, muss jedoch ein neuartiger Dialog stattfinden, bei dem Radiolog:innen und Computer während des gesamten Lesevorgangs ein gemeinsames Verständnis eines bestimmten Falls aufrechterhalten. Die strukturierte Befundung ist ein Ansatz, der einen solchen Dialog ermöglicht und der sicherstellt, dass alle von den Radiolog:innen eingegebenen oder überprüften Daten als Input für die spätere KI-Unterstützung in medizintechnischen Produkten dienen. Ein KI-gestützter Ansatz für die strukturierte Befundung kann also dazu führen, dass die strukturierte Befundung zu einem Teil der Primärversorgung wird und Radiolog:innen in die Lage versetzt, qualitativ hochwertige Daten zu produzieren, die für das KI-Training zugänglich sind. Genau dieses Ideal führt uns zu der langfristigen Vision, dass Computer vorläufige Berichte erstellen, die Radiolog:innen überprüfen und mit ihrem Expertenwissen ergänzen können. Damit also die KI in der Radiologie ihr Versprechen halten kann, die Patientenversorgung und die Lebensqualität zu verbessern, muss ein Bild schlussendlich Tausende von strukturierten Datenpunkten wert sein.
Wir bei Mint Medical verstehen die Verknüpfung von strukturierten radiologischen Daten und KI sowie die damit verbundenen Möglichkeiten und Vorteile. Ein einheitliches Lexikon, eine homogene Sprache sowie kontextbezogene Informationen in Berichten sind die Grundlage für zukünftige Entwicklungen in der Radiologie. Lassen Sie uns gemeinsam das volle Potenzial von Daten erschließen und Informationen in verwertbare Erkenntnisse umwandeln, um so zum Fortschritt der Gesundheitssysteme beizutragen. Wenn Sie mehr über die Bedeutung von strukturierten Berichten oder mint Lesion™ erfahren möchten, vereinbaren Sie hier einen Termin für eine Demo.
Quellen:
[1] Ganeshan, Dhakshinamoorthy, Phuong-Anh Thi Duong, Linda Probyn et al. 2018 “Structured Reporting in Radiology.” Radiology Research Alliance 25: 66-73.
[2] Christlein, Daniel, Johannes Kast, Matthias Baumhauer. 2021. „Gegenwärtige Entwicklung in der Healthcare-Informationstechnologie: Auswirkungen auf die strukturierte Befundung.“ Radiologie 61: 986-994.
[3] Vosshenrich, Jan, Ivan Nesic, Daniel T. Boll et al. 2023. “Investigating the Impact of Structured Reporting on the Linguistic Standardization of Radiology Reports Through Natural Language Processing Over a 10-Year Period.” Imaging Informatics and Artificial Intelligence 33: 7496-7506.
[4] Jorg, Tobias, Moritz C. Halfmann, Fabian Stoehr et al. 2024. “A Novel Reporting Workflow for Automated Integration of Artificial Intelligence Results Into Structured Radiology Reports.” Insights into Imaging 15.80: 1-10.
[5] McKee, Jennie. 2022. “Responding to ‘Relentless Growth’ of the Radiologist’s Workload.” RSNA, 26 October 2022, www.rsna.org/news/2022/october/workload-and-burnout.
[6] Markotić, Vedra, Tina Pojužina, Dorijan Radančević et al. 2021. “The Radiologist Workload Increase; Where Is the Limit?: Mini Review and Case Study.” Psychiatr Danub 33.4: 768-770.
[7] Pinto dos Santos, Daniel and Bettina Baeßler. 2018. “Big Data, Artificial Intelligence, and Structured Reporting.” European Radiology Experimental 2.42: 1-5.
[8] Filev, Peter D. and Arthur E. Stillman. 2022. “Structured Reporting in Medical Imaging: The Role of Artificial Intelligence.” In: De Cecco, C.N., van Assen, M., Leiner, T. (eds). Artificial Intelligence in Cardiothoracic Imaging: Contemporary Medical Imaging. Humana, Cham.
[9] European Society of Radiology (ESR). 2023. “ESR Paper on Structured Reporting in Radiology—Update 2023.” Insights Imaging 14: 1-8.
[10] Pinto dos Santos, Daniel, Johann-Martin Hempel, Peter Mildenberger. 2019. “Structured Reporting in Clinical Routine.” Fortschritte Röntgenstrahlung 191: 33 – 39.
[11] European Society of Radiology (ESR). 2018. “ESR Paper on Structured Reporting in Radiology.” Insights Imaging 9: 1-7.
[12] Pinto de Santos, Daniel, Sebastian Brodehl, Bettina Baeßler et al. 2019. “Structured Report Data Can Be Used to Develop Deep Learning Algorithms: A Proof of Concept in Ankle Radiographs.” Insights Imaging 10: 93: 1-8.
[13] Fanni, Salvatore Claudio, Michela Gabelloni, Angel Alberich-Bayarri et al. 2022. “Structured Reporting and Artificial Intelligence.” In: Fatehi, M., Pinto dos Santos, D. (eds). Structured Reporting in Radiology: Imaging Informatics for Healthcare Professionals. Springer, Cham.
[14] Fink, Matthias A. 2023. “From Data to Insights: How Natural Language Processing and Structured Reporting Advance Data-Driven Radiology.” European Radiology 33: 7494-7495.
[15] Brady, Adrian P., Bibb Allen, Jaron Chong et al. 2024. “Developing, Purchasing, Implementing and Monitoring AI Tools in Radiology: Practical Considerations; A Multi-Society Statement from the ACR, CAR, ESR, RANZCR & RSNA.” Insights into Imaging 15.16: 1-19.