Der Einfluss künstlicher Intelligenz (KI) auf die Radiologie hat in den letzten Jahren stark zugenommen. Heute kann KI auf viele Aspekte der täglichen Arbeit in einer Radiologieabteilung angewendet werden, von der Automatisierung operativer Aufgaben und der Bildrekonstruktion nach dem Scannen bis hin zum Lesen und Interpretieren von Bildern. Darüber hinaus wird KI in verwandten medizinischen Disziplinen eingesetzt, z. B. in der bildgebenden Forschung in der Radio-Onkologie zur Segmentierung von Organen und Läsionen, zur Bildregistrierung, zur Erkennung von Referenzpunkten/Markern, im Bereich Radiomics etc.[1]. Die Nutzer:innen von KI begegnen jedoch nach wie vor der Herausforderung, KI-Technologien effektiv in ihre bestehende IT-Infrastruktur und Arbeitsabläufe zu integrieren. Gleichzeitig haben KI-Entwickler:innen Schwierigkeiten, KI-Systeme effektiv mit aussagekräftigen Daten zu trainieren.
Integration von KI in den bestehenden radiologischen Arbeitsablauf - die wenig diskutierte Herausforderung
Da es heute noch keine allgemein standardisierte Methode zur Durchführung einer radiologischen Befundung gibt, ist die einfache Integration von KI in den radiologischen Arbeitsablauf, ohne die etablierten Prozesse zu stören, gelinde gesagt eine Herausforderung. In der Regel arbeiten Radiolog:innen mit zwei getrennten Systemen: PACS für die Bildbetrachtung und RIS oder Befundungssystem für das Diktieren der Befundberichte. Die Integration von KI in einen solchen Arbeitsablauf würde bedeuten, dem Prozess eine dritte, nicht verbundene Dimension hinzuzufügen.
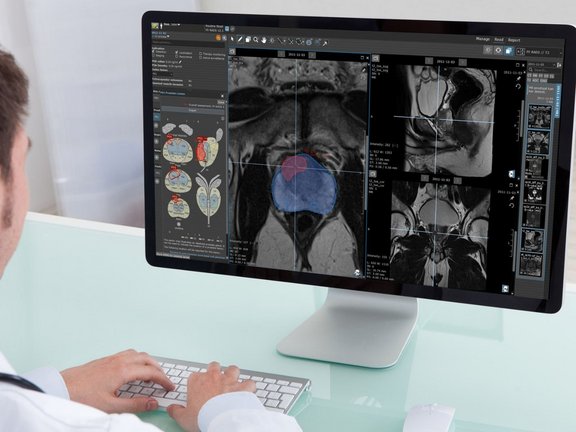
Derzeit bieten die meisten KI-Anbieter Algorithmen für die computergestützte Erkennung von Krankheiten an, die als Black-Box-Tools funktionieren, bei denen die Nutzer:innen nur mit der Eingabe interagieren und das Ergebnis beobachten können, ohne die zugrunde liegenden Prozesse oder die verwendeten Algorithmen verstehen zu müssen. Ein typischer Arbeitsablauf besteht darin, dass medizinische Bilder an diese Tools oder an cloudbasierte KI-Systeme gesendet werden. Die KI-Algorithmen generieren daraufhin Befunde und senden Screenshots der Befunde an das PACS zurück, wodurch sie potenziell für alle Nutzer:innen mit Zugang zum PACS zugänglich werden. Ein anderer Ansatz zur Workflow-Integration besteht in einer speziellen Anwendung, die aus dem PACS heraus gestartet werden kann und den Radiolog:innen die Möglichkeit gibt, die KI-generierten Befunde zu akzeptieren oder abzulehnen. Akzeptierte Befunde werden häufig als Screenshots, sogenannten DICOM Secondary Captures, an das PACS gesendet.
Eine große Herausforderung besteht darin, dass die von der KI durchgeführten Messungen, die als statische Screenshots dargestellt werden, in der Regel nicht von den Radiolog:innen bearbeitet oder verändert werden können. Dies schränkt die Möglichkeit ein, notwendige Anpassungen oder Korrekturen vorzunehmen, wenn Fehler erkannt werden. Da es das primäre Ziel der KI ist, zu verhindern, dass Radiolog:innen verdächtige Befunde übersehen, neigen KI-Systeme zu überhöhter Vorsicht, was häufig zu einer hohen Anzahl falsch positiver Befunde führt. Wenn also ein KI-System eine beträchtliche Anzahl von Befunden generiert, der Radiologe/ die Radiologin aber nur mit einem Bruchteil davon einverstanden ist, steht diese:r vor der gewaltigen Aufgabe, das Verwerfen der zusätzlichen KI-Befunde im Befundbericht erklären zu müssen. Dies erfordert jedes Mal eine Unterbrechung des regulären Arbeitsablaufs, was die Komplexität eines ohnehin schon komplizierten und langwierigen Freitextbefundes weiter erhöhen kann.
Diese Situation wirft Fragen bezüglich der Struktur und des Inhalts des radiologischen Befundberichts auf und wie dieser angepasst werden sollte, um KI-Befunde effektiv zu integrieren, ohne den Befundungsprozess wesentlich zu unterbrechen und die Glaubwürdigkeit der Radiolog:innen zu gefährden.
Ein standardisierter und strukturierter Befundungsprozess ist entscheidend für eine nahtlose KI-Integration
Das Gleichgewicht zwischen der Integration von KI-generierten Informationen und dem Fachwissen der Radiolog:innen ist entscheidend, um einen reibungslosen Arbeitsablauf zu gewährleisten, der die Vorteile der KI optimiert und gleichzeitig die Rolle der Radiolog:innen als letzte Entscheidungsträger im Diagnoseprozess aufrechterhält. In dieser Hinsicht bietet eine standardisierte und strukturierte Befundungsstruktur, wie sie von mint Lesion™ angeboten wird, eine solide Grundlage für die nahtlose Integration von KI in radiologische Arbeitsabläufe.
"Mit unserem interaktiven Ansatz, der Radiolog:innen durch die radiologische Befundung führt, haben wir den Weg für die Integration von KI in unser Produkt geebnet und die Zugänglichkeit und Nutzbarkeit sowohl der KI-Technologie als auch ihrer Ergebnisse verbessert. Anstatt den Ärzten ein separates Tool anzubieten, können wir die KI-Ergebnisse direkt in mint Lesion™ integrieren, das System, das sie für die Befundung und Dokumentation strukturierter Befundberichte verwenden. Der größte Vorteil von mint Lesion™ besteht darin, dass es Radiolog:innen ermöglicht, sich aktiv mit KI-generierten Befunden auseinanderzusetzen. Sie können alle Befunde und Konturen, mit denen sie nicht einverstanden sind, in einem einzigen, ununterbrochenen Arbeitsablauf überprüfen, verwerfen oder anpassen. Darüber hinaus hat mint Lesion™ das Potenzial, mehrere KI-Befunde aus verschiedenen Quellen zu integrieren, was Flexibilität und die Möglichkeit bietet, verschiedene Befunde innerhalb der Plattform auszuwählen und zu verwalten. Es ist nicht notwendig, zwischen verschiedenen Systemen zu wechseln, was einen schlankeren und effizienteren Prozess ermöglicht und die KI-Befunde als strukturierte Datenpunkte in einen strukturierten radiologischen Befund integriert."
Matthias Baumhauer,
Mitgründer und Geschäftsführer Mint Medical GmbH
Im Gegensatz zu anderen Plattformen, die die Nachbearbeitung von KI-generierten Befunden einschränken, ermöglicht mint Lesion™ den Radiolog:innen die Feinabstimmung von Konturen und die Durchführung notwendiger Anpassungen. Darüber hinaus stellt es dem Anwender kontextbezogene Informationen zur Verfügung, um KI-Befunde durch die Synchronisierung verwandter Bilder und aller früheren Messungen effektiv zu bewerten. Das System ermöglicht auch die Übernahme von KI-Ergebnissen als Grundlage für weitere klassifizierte und zugeordnete Beobachtungen. Diese operative Integration der KI in den Befundungsprozess stellt sicher, dass relevante und präzise KI-Befunde nahtlos in strukturierte Befundberichte einfließen und den zuweisenden Medizinern oder Tumorboards umfassende Informationen zur Verfügung gestellt werden.
Probleme jenseits der Grenzen moderner KI-Algorithmen
Heutige KI-Produkte für die computergestützte Erkennung von Pathologien verwenden in der Regel ausgewählte, annotierte Bilder für das überwachte maschinelle Lernen von KI-Algorithmen. Während dieser Ansatz bis zu einem gewissen Grad zufriedenstellende Ergebnisse liefert, wird er problematisch, wenn es darum geht, die verschiedenen Ausprägungen einer bestimmten Pathologie zu erfassen. Beispielsweise können vaskuläre Anomalien oder Läsionen in ihren visuellen Merkmalen variieren, so dass es für die Entwickler schwierig ist, einen ausgewogenen Trainingsdatensatz zu erstellen, der all diese verschiedenen Subtypen angemessen abdeckt.
Eine der wichtigsten Anforderungen der KI-Entwickler sind daher qualitativ hochwertige und umfangreiche longitudinale Daten mit detailliertem semantischen Kontext pro Krankheitsbild. Die Verfügbarkeit umfangreicher und vielfältiger Datensätze ist für das Training robuster KI-Algorithmen von entscheidender Bedeutung, aber die unterschiedlichen Bildgebungsparameter, Protokolle und klinischen Situationen in den verschiedenen Gesundheitseinrichtungen machen es schwierig, standardisierte Daten für die KI-Forschung zu sammeln.
Darüber hinaus ist die Erhebung von Gesundheitsdaten für KI-Training und -Forschung sehr komplex und mit Einschränkungen verbunden, insbesondere in der Europäischen Union, wo medizinische Bilder als personenbezogene Daten gelten und somit in den Geltungsbereich der DSGVO fallen. Es bleibt also eine wichtige Aufgabe für Forscher und politische Entscheidungsträger, ein Gleichgewicht zwischen Datenschutzbestimmungen und der Ermöglichung innovativer KI-Entwicklungen zu finden.
Das Potenzial der KI über die Konturierung hinaus
Zunehmend setzt sich die Erkenntnis durch, dass künftige KI-Systeme über ein tieferes Verständnis von Krankheiten verfügen sollten, das über bloße Messungen, Konturen und Bilder hinausgeht. Um KI in dieser Hinsicht zu trainieren, reicht es nicht aus, sie mit einer Reihe von kommentierten Bildern zu konfrontieren. Um die Fähigkeiten der KI, präzise Messungen und wertvolle Unterstützung zu liefern, wirklich nutzen zu können, muss sie die potenziellen Ergebnisse eines radiologischen Berichts und deren Auswirkungen auf die nachfolgende Diagnose und Therapie lernen und verstehen, z. B. wenn ein Tumor in eine benachbarte Struktur eindringt und dies als entscheidender Wendepunkt für mögliche Therapieoptionen angesehen wird. Ohne Kenntnis des therapeutischen Kontexts, der anatomischen Details, der patientenspezifischen Faktoren und der verfügbaren Behandlungsoptionen bleibt die Fähigkeit der KI, wirksame Unterstützung zu leisten, sehr begrenzt.
Die KI der Zukunft sollte in der Lage sein, Antworten zu geben, die die Bedeutung relevanter klinischer Faktoren berücksichtigen. Indem wir der KI diesen zusätzlichen Kontext zur Verfügung stellen, können wir einen Assistenten schaffen, der nicht nur verdächtige Befunde auf einem Bild identifiziert, sondern möglicherweise auch einen wesentlichen Teil eines radiologischen Befundes erstellen kann.
Um die KI mit diesem zusätzlichen Kontext auszustatten, müssen jedoch zunächst die oben genannten Herausforderungen bewältigt werden, von denen einige durch den Einsatz von Software wie mint Lesion™ wirksam verringert werden können. Durch die standardisierte und strukturierte Erfassung von Bilddaten kann mint Lesion™ den Forscher:innen qualitativ hochwertige Daten im benötigten Format zur Verfügung stellen und so die Entwicklung anspruchsvollerer KI-Algorithmen unterstützen.
[1] Tang X. The role of artificial intelligence in medical imaging research. BJR Open. 2019 Nov 28;2(1):20190031. doi: 10.1259/bjro.20190031. PMID: 33178962; PMCID: PMC7594889.